Proteínas, péptidos, enzimas, factores de crecimiento y más.
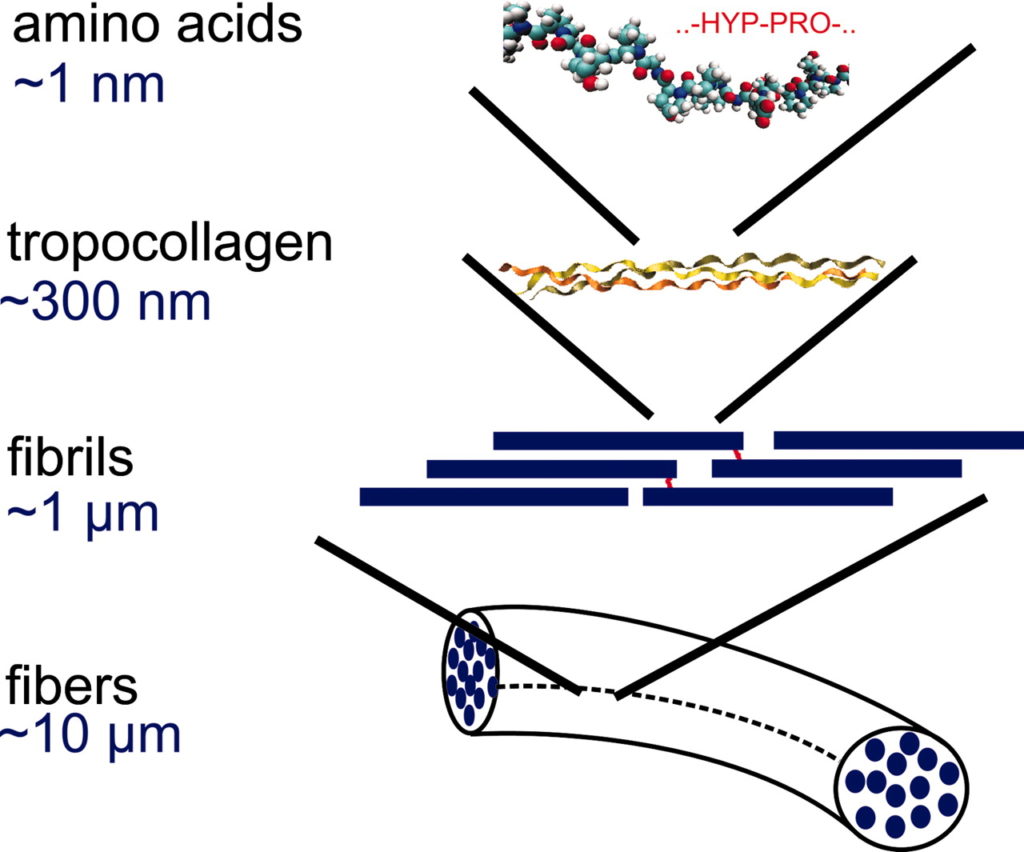
Figura. Estructura del colágeno
¿Por qué las proteínas son tan complicadas? Porque tienen que serlo. Pensalo bien: cada proteína tiene una función diferente. Pensá en todas las enzimas que son necesarias para convertir el azúcar en dióxido de carbono, agua y energía. Y todo en nuestros cuerpos (y en las plantas, las bacterias, en tu gato) es igual de complicado. Por eso es difícil mejorar un proceso biológico y es tan fácil estropearlo. Cada vez que te den ganas de jugar con tu cuerpo, detenete y pensá en lo complicado que es. ¿Sabes lo suficiente como para meterte en tal cosa? Te aconsejo: ¡NO LO HAGAS!
De todos modos, volviendo a las proteínas,
Algunos hechos, aquí y allá
1) los péptidos están hechos de algunos aminoácidos
2) las proteínas están hechas de muchos aminoácidos
3) el factor de crecimiento epidérmico y el factor de crecimiento de queratinocitos son proteínas (estructura) y factores de crecimiento (función)
4) la superóxido dismutasa es una proteína (estructura) y una enzima
4) el glutatión es un péptido, esencial para mantener un estado desoxidante óptimo
5) las enzimas son proteínas (no te preocupes por las excepciones)
6) el colágeno y la elastina son insolubles y solo los producen animales como nosotros, los humanos. ¡El colágeno vegetal existe solo en la imaginación de los publicistas!
Podemos clasificar a las moléculas por sus estructuras o por lo que hacen. En el caso de las proteínas, su estructura puede ser muy compleja porque pueden hacer muchas cosas diferentes: pueden estar involucradas en el mantenimiento de una estructura, como el colágeno o la elastina, o pueden ser enzimas, acelerando reacciones químicas para que la vida sea posible. O pueden comunicar información, como un factor de crecimiento que le dice a una célula qué hacer.
En cuanto a la estructura, detengámonos en las proteínas y de qué están hechas. La estructura de una proteína determina qué puede hacer y qué no.
Aminoácidos
En las proteínas se encuentran comúnmente veinte aminoácidos de origen natural. Todos tienen características estructurales tanto comunes como únicas, las que le dan a cada aminoácido sus propiedades distintivas.
Estructura general: extremo amino – carbono alfa (+ radical especial – grupo R) – extremo carboxilo
Los aminoácidos pueden existir en dos formas en dos formas, que son estereoisómeros una de la otra. La forma natural de las proteínas es la forma L- (levo). En la forma L-, el grupo amino se coloca a la izquierda del carbono alfa.
Las características de los aminoácidos son el resultado de sus grupos R. Los aminoácidos muy a menudo son clasificados de acuerdo a las propiedades de sus grupos R.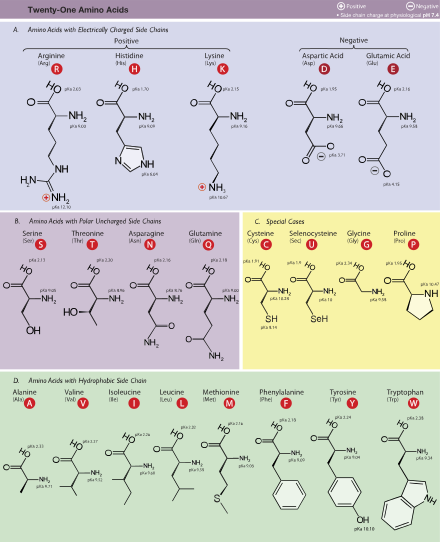
Figura. Los aminoácidos. De Wikipedia.
1. No polar: glicina, leucina: los aminoácidos con cadenas laterales no polares son hidrófobos
2. Polar, pero sin carga: serina, cisteína, asparagina: la cisteína es importante debido a su capacidad para formar enlaces covalentes con otras Cys. Estos aminoácidos son hidrofílicos.
3. Aromáticos: fenilalanina, tirosina, triptófano: estos aminoácidos son relativamente no polares, por lo que son hidrófobos. Sin embargo, la tirosina puede formar enlaces de hidrógeno a través de su grupo -OH y este grupo también es relativamente reactivo y puede modificarse de modo covalente.
4. Cargados negativamente (acídicos, buenos donantes de protones) – Glutamato, Aspartato: estos aminoácidos están cargados, de modo que son hidrófilos.
5. Cargados positivamente (malos donantes básicos de protones) – Arginina, Histidina, Lisina: estos aminoácidos también son hidrófilos. Importantes en las interacciones electrostáticas entre sustancias (como en la unión del ADN).
Los aminoácidos se ionizan en solución
Forma iónica a pH muy bajos: + H3N-CH2-COOH (glicina, todos los H disociables presentes)
A pH neutro: + H3N-CH2-COO- (la forma zwitterion de iones bipolares o híbridos)
Forma iónica a pH muy alto: H2N-CH2-COO- (la glicina ha perdido todo su H disociable)
Con un pH cercano a 6, la glicina puede tanto donar como aceptar protones. La carga general de un aminoácido dado y su capacidad relativa para aceptar o donar protones dependerá del pH de la solución. Se disuelve y los pKa de los grupos ionizables.
Péptidos
Los aminoácidos pueden formar péptidos. Un dipéptido (dos aminoácidos unidos por un enlace peptídico), tripéptido (3), tetrapéptido (4), etc. Cuando no recuerdes el nombre de los números en griego, usá oligopéptido (oligo = pocos). Los péptidos suelen estar representados por una secuencia de letras, una para cada aminoácido y, a veces, por tres letras para cada aminoácido.
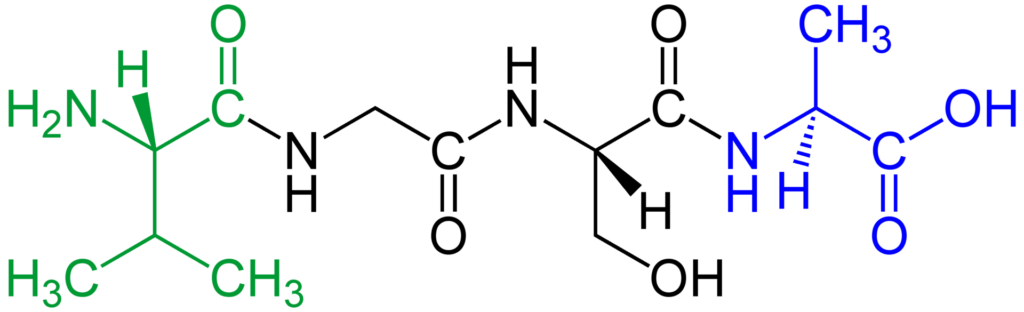
Figura: Un péptido
Los enlaces peptídicos se forman mediante una reacción de condensación y la eliminación de una molécula de agua. Las cadenas largas de aminoácidos forman polipéptidos (generalmente menos de 100 aminoácidos) o proteínas (si tienen más de 100 aminoácidos). Los enlaces peptídicos son rígidos debido al carácter de doble enlace parcial.
Estructura primaria de una proteína
La secuencia de aminoácidos en una proteína se conoce como su estructura primaria y a menudo a cada aminoácido dentro de una molécula de proteína se lo denomina residuo. La estructura primaria revela mucho sobre una proteína. El número y la ubicación de los residuos de cisteína indican dónde se pueden formar los enlaces disulfuro (un indicador de cómo se pueden plegar las proteínas).
Las proteínas suelen contener aminoácidos que han sido modificados. Los lípidos forman lipoproteínas, los carbohidratos forman glicoproteínas, los fosfatos forman fosfoproteínas, etc.
Por qué debemos tener cuidado cuando tratamos con proteínas
Las proteínas se pueden desnaturalizar (es decir, pierden su estructura y funcion) en cualquiera de las siguientes condiciones:
1) Extremos de pH (trastornan las interacciones iónicas y los enlaces H)
2) Detergentes (SDS, Triton; trastornan las interacciones hidrofóbicas)
2) Agentes desnaturalizantes (que trastornan las interacciones hidrofóbicas) como urea o guanidina
3) Alcoholes como el etanol (también trastornan las interacciones hidrofóbicas)
El resultado de la desnaturalización es una pérdida de la función de la proteina (como su función enzimática). Si a posteriori se elimina el agente desnaturalizante, la proteína puede llegar reformarse, aunque esto es muy variable.
Estructura secundaria de la proteína
Hay algunos motivos comunes que espontáneamente pueden formar tramos cortos de secuencias de aminoácidos:
1) Hélice alfa – que es la estructura más compacta que una cadena de aminoácidos puede asumir entre distancias: es de 1,5 Angstroms y tiene 3,6 aminoácidos por turno. Se estabiliza mediante enlaces H intramoleculares cada 4 aminoácidos y minimiza la repulsión entre los grupos R (que se proyectan hacia el exterior de la hélice); por lo tanto, algunos aminoácidos (R demasiado grande, por ejemplo) no se encuentran comúnmente en estas estructuras.
2) Conformación beta: es la forma más extendida que puede asumir una cadena de aminoácidos; la distancia intra-aminoácida es de 3,5 Angstroms. Las cadenas de aminoácidos en esta conformación se pueden unir mediante enlaces H intra o intercatenarios para formar una lámina de pliegues beta.
3) Giro beta: a menudo se encuentran cadenas de conexión de aminoácidos en la lámina beta. Suelen tener una Pro porque está torcido o una Gly porque su grupo R es pequeño.
Estructura terciaria de proteínas
– es el resultado de interacciones entre las estructuras secundarias y es la estructura 3-D de la proteína final.
– se pueden describir porciones de la estructura 3-D en términos de dominios proteicos. Esto se refiere a una región funcional, como el sitio de unión del sustrato, el sitio de unión del oxígeno, la región catalítica, el sitio de unión de ATP, el sitio de fosforilación.
La estructura primaria de una proteína, es decir, la secuencia de aminoácidos, contiene toda la información necesaria para formar una estructura tridimensional.
La estructura cuaternaria se aplica solo a proteínas que tienen más de una subunidad. La asociación de subunidades en una unidad macromolecular funcional es la estructura cuaternaria.
Péptidos cortos:
Los péptidos cortos (3-6 aminoácidos) son demasiado simples para dar forma al tipo de estructura espacial que puede “encajar” (fit) en algo que nos sea de interés. Se descompondrán y serán utilizados. Es posible que logres “acortar” una proteína manteniendo su función, pero antes tenés que demostrar que esto es posible. No se le puede pedir a un péptido corto que haga el trabajo de una proteína compleja.
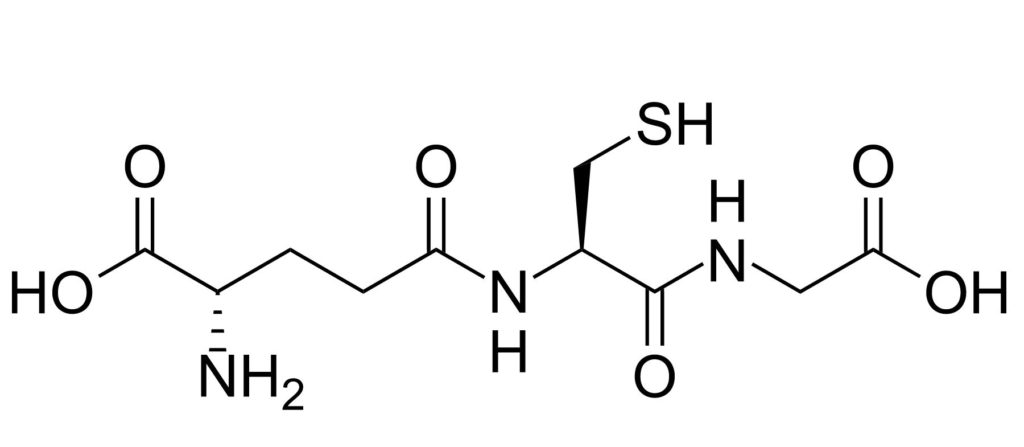
Figura: glutatión
El glutatión (reducido) es un péptido que ayudará a tu piel a afrontar el estrés oxidativo provocado por la contaminación e incluso por nuestro propio metabolismo.
Péptidos largos (polipéptidos, proteínas cortas)
El factor de crecimiento epidérmico (EGF) se pliega de tal manera que encaja en el receptor de EGF y da comienzo a una compleja cadena de reacción química en tu piel que dará como resultado más síntesis de proteínas, más división celular y una piel más suave y agradable. Una pequeña gota de esta proteína en una crema, loción o suero a base de agua, y tu piel te lo agradecerá.
En Skin Actives producimos proteínas idénticas a las que ya poseemos en nuestro cuerpo; harán un trabajo similar y no causarán alergias (a estructura similar, el cuerpo no puede notar la diferencia).
Traducido por la Dra Cecilia Hidalgo
